Llamamos electronegatividad a la capacidad que tienen los átomos de una molécula para atraer electrones que son compartidos entre dos átomos cuando estos se unen en un enlace químico.
Por ejemplo, dos átomos poseerán similar electronegatividad si comparten la misma cantidad de átomos. En cambio, si uno de ellos tiene tendencia a ganar electrones, se dirá que posee mayor electronegatividad.
Importancia de la electronegatividad
Uno de los usos más importantes que podemos darle es que la diferencia de electronegatividad entre dos átomos puede usarse como indicador para prever la reactividad entre ambos átomos. Esto significa que un átomo con la suficiente electronegatividad puede absorber los electrones de su vecino hasta oxidarlo.
Propiedades de la electronegatividad
Esta propiedad depende de la estructura de los átomos, es decir, de la disposición de los electrones y el núcleo. Vale decir que la electronegatividad mide la efectividad de la carga nuclear para saber si hay espacios libres en el orbital externo.
Se dice que un átomo posee mayor electronegatividad cuando es propenso a atraer electrones externos. Un ejemplo de átomos con gran electronegatividad son los halógenos, que pueden conservar su nube electrónica compacta sin importar la repulsión interelectrónica.
Un ejemplo más claro son los átomos de potasio y de cloro: el primero mantiene 19 electrones dentro de un radio de 196 picometros y una electronegatividad de 0,445, mientras que el segundo átomo mantiene 17 electrones dentro de un radio de 99,4 picometros y una electronegatividad de 3,475.
La oxidación también influye cuando hablamos de electronegatividad: es sabido que los átomos con varios estados de oxidación tienen menos electronegatividad que los estados de oxidación menores. Esto queda más claro al mirar la electronegatividad del aluminio: Al(I) es 0,84 , Al(II) es 1,63 y del Al(III) es 1,714.
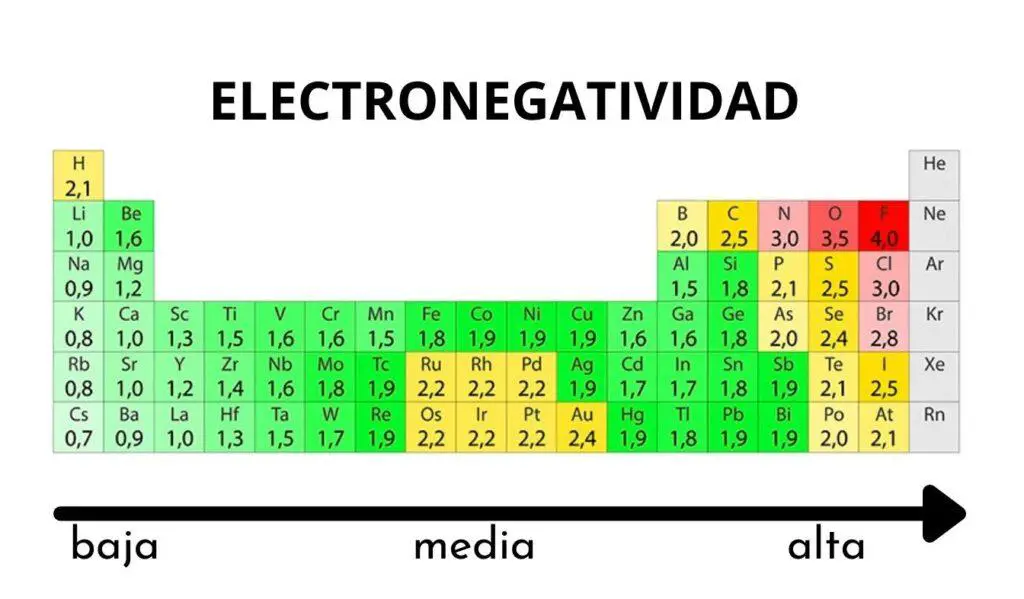
Si nos fijamos en la Tabla Periódica, podemos ver que la electronegatividad aumenta de izquierda a derecha en un período y, a la vez, de arriba a abajo en un grupo. De este modo, vemos a simple vista que el litio es el elemento más electronegativo, mientras que el francio es su opuesto, ambos en el grupo de los alcalinos. El sodio y el cloro son el menos electronegativo y más electronegativo respectivamente y en el tercer periodo.
Tablas de electronegatividad
Si bien no es posible medir la electronegatividad de manera directa, sí puede hacerse a través de otras propiedades atómicas y es por ello que existen algunas escalas de la electronegatividad como la de Pauling, que es la más utilizada y actualizada ya que fue corregida en 2018.
Tabla de electronegatividad de Pauling
El de Linus Pauling (1901-1995) es el método más admitido para calcular los valores de electronegatividad; dicho cálculo se realiza al medir la energía de enlace del elemento.
Tabla periódica de valores actualizados de electronegatividad
Se trata de una nueva tabla de electronegatividad publicada en 2018 por los químicos Martin Rahm, Tao Zeng y Roald Hoffmann, quienes tomaron como base el valor de energía de unión promedio de los electrones de valencia. Este método les sirvió para determinar 96 nuevos valores de electronegatividad correspondientes a 96 elementos de la tabla periódica.
Las unidades para medir esta tabla se miden en unidades de energía por electrón, es decir, (eV e-1). Si se quiere convertir estos valores a los de la escala de Pauling debemos tener en cuenta que la equivalencia es 1 unidad de Pauling = 6 eV e-1.
Relación entre electronegatividad y tipo de enlace
Veamos cómo es esta relación en cada caso.
- Átomos iguales y en los cuales la diferencia de electronegatividad sea igual a cero: los electrones del enlace se comparten de manera equitativa para formar un enlace covalente no polar. El ejemplo más claro es el oxígeno molecular (O-O) que, al tener lógicamente dos átomos iguales, su electronegatividad es cero.
- Átomos enlazados cuya electronegatividad tenga una diferencia mayor de 0,4 y menor que 1,7 (en la escala de Pauling): se realizará un enlace covalente polar y en el cual los electrones se agruparán al átomo más electronegativo. Un ejemplo es la molécula de ácido clorhídrico (HCl) en la cual la diferencia de electronegatividad es de 0,9 y los electrones se agrupan en torno al cloro, puesto que el índice de electronegatividad en cada uno es de Cl=3,0; H=2,1
- El enlace iónico se da entre átomos cuya diferencia de electronegatividad sea mayor a 1,9 en la escala de Pauling. En este caso, en lugar de compartirse, los electrones del elemento menos electronegativo se transfieren al de mayor electronegatividad. Esto se da, por ejemplo, en el caso del el cloruro de sodio, NaCl, el cual se forma mediante un enlace iónico entre el sodio, cuya electronegatividad es de 0,9, y el cloro, que posee una electronegatividad igual a 3.

