La valencia es un concepto químico que se refiere a la capacidad de un átomo de un elemento químico para combinarse con átomos de otros elementos químicos para formar compuestos químicos. En otras palabras, la valencia de un átomo se refiere a la cantidad de enlaces químicos que puede formar con otros átomos. Por ejemplo, el hidrógeno tiene una valencia de 1, lo que significa que puede formar un enlace químico con un átomo de oxígeno para formar agua (H2O).
¿Cuáles son los tipos de valencia?
Hay diferentes tipos de valencia, pero uno de los más comunes es la valencia principal o valencia normal. La valencia principal es el número de enlaces químicos que puede formar un átomo de un elemento químico de forma normal o usual. Por ejemplo, el carbono tiene una valencia principal de 4, lo que significa que puede formar cuatro enlaces químicos con otros átomos.
Otro tipo de valencia es la valencia secundaria o valencia alternativa. La valencia secundaria se refiere a la capacidad de un átomo de un elemento químico para formar un número diferente de enlaces químicos en ciertas circunstancias. Por ejemplo, el carbono también puede tener una valencia secundaria de 2, lo que significa que puede formar dos enlaces químicos en lugar de cuatro en ciertas condiciones.
Además podemos nombrar la Valencia real, que se refiere a la valencia efectiva o real de un átomo en un compuesto químico, que puede ser diferente de su valencia nominal en algunos casos.
Así también existe la Valencia de oxidación, que se refiere a la capacidad de un átomo para ceder o ganar electrones en una reacción química, lo que se relaciona con su capacidad para oxidarse o reducirse.
Valencia principal
La valencia principal es un concepto de la química que se refiere a la capacidad de un átomo de combinarse con otros átomos para formar un compuesto químico. La valencia principal se relaciona con el número de enlaces que un átomo puede formar con otros átomos. Por ejemplo, el átomo de carbono tiene una valencia principal de cuatro, lo que significa que puede formar cuatro enlaces con otros átomos. Esto le permite combinarse con una amplia variedad de elementos químicos para formar compuestos complejos como las moléculas orgánicas.
Valencia secundaria
La valencia secundaria es un concepto relacionado con la valencia principal, pero se refiere a la capacidad de un átomo para formar enlaces dobles o triples en lugar de enlaces sencillos. Los átomos pueden tener una valencia secundaria diferente a su valencia principal, lo que les permite formar compuestos químicos con una estructura diferente a la que se obtiene con enlaces sencillos. Por ejemplo, el átomo de oxígeno tiene una valencia principal de dos, pero también puede formar enlaces dobles, lo que le da una valencia secundaria de cuatro. Esto permite al oxígeno combinarse con otros átomos de manera diferente a como lo haría si solo pudiera formar enlaces sencillos.
Valencia Real
La valencia real de un elemento químico se refiere a la cantidad real de electrones que el elemento puede aceptar o ceder en una reacción química. La valencia real puede ser diferente de la valencia formal, que se determina en base a reglas de enlace químico y no necesariamente refleja la cantidad real de electrones que se intercambian en una reacción. Por ejemplo, el oxígeno tiene una valencia formal de 2, pero su valencia real puede variar entre -2 y -1, dependiendo del compuesto químico en el que se encuentre.
Valencia de Oxidación
La valencia de oxidación se refiere a la cantidad de electrones que un elemento puede aceptar o ceder en una reacción química de oxidación-reducción. En una reacción de oxidación-reducción, un elemento se oxida (pierde electrones) y otro elemento se reduce (gana electrones). La valencia de oxidación se determina en base a la cantidad de electrones que un elemento puede aceptar o ceder en una reacción, y se expresa como un número entero positivo o negativo. Por ejemplo, en la reacción química entre el hierro y el cloro, el hierro se oxida y pierde electrones, por lo que su valencia de oxidación es positiva, mientras que el cloro se reduce y gana electrones, por lo que su valencia de oxidación es negativa.
¿Qué diferencia existe entre el número de oxidación y la valencia?
El número de oxidación de un elemento se refiere a la cantidad de electrones que un átomo de ese elemento ha ganado o perdido en un compuesto químico. La valencia, por otro lado, se refiere a la capacidad de un átomo de un elemento para combinarse con otros átomos y formar enlaces químicos.
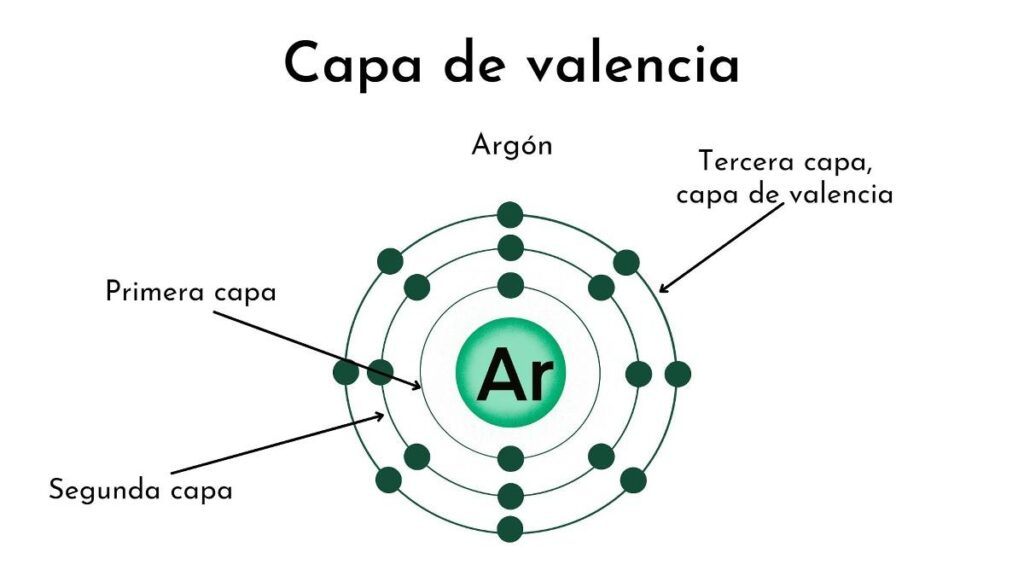
¿Qué es la órbita de valencia?
La órbita de valencia es la última capa o nivel de energía en un átomo. Es la capa más externa del átomo y es la que contiene los electrones más alejados del núcleo. Los electrones que se encuentran en la órbita de valencia tienen una gran influencia en la química del átomo, ya que son los que participan en los enlaces químicos con otros átomos.