Se denomina enlace covalente al tipo de enlace químico que se da al enlazar dos átomos para formar una molécula. Este enlace permite que se compartan electrones de su capa de valencia, alcanzando la regla del octeto, postulada por Gilbert Newton Lewis, que refiere a la estabilidad de los átomos.
Regla de los octectos
Esta regla, descubierta por el físicoquímico Gilbert Newton Lewis en 1916, describe la tendencia que se puede observar en algunos elementos de la tabla periódica cuando alcanzan una configuración estable. Por ejemplo, los átomos más estables que integran la tabla periódica tienen ocho electrones en su capa de valencia, como el neón (Ne) o el Argón (Ar).
Para poder alcanzar la estabilidad de los gases nobles, otros átomos reaccionan con más átomos para poder compartir electrones y así llegar a los ocho necesarios para dicha estabilidad.
La regla de los octetos es muy importante para conocer y descubrir la estructura de los átomos y para poder así predecir cómo se van a comportar al relacionarse con otros elementos. Esta regla tiene excepciones, debido a que no se cumple con las moléculas de Boro (B) y Berilio (Be).
Tipos de enlaces covalentes
Para poder clasificar a los diferentes tipos de enlaces covalentes es necesario tener en cuenta la electronegatividad de los átomos que integran el enlace; así como también el número de electrones que se comparte entre ellos.
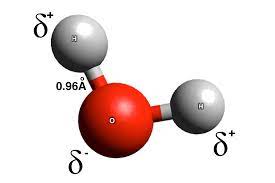
Enlace covalente polar
Sucede cuando una molécula está compuesta por más de un átomo. La polaridad se produce cuando un átomo atrae electrones con mayor intensidad, generando una mayor concentración de los mismos dentro de la molécula.
Dentro de la misma molécula conviven los electrones que tienen una carga parcialmente negativa con otros que tienen una carga parcialmente positiva. Es por esto que este enlace recibe el nombre de polar, por la polarización que se encuentra entre sus electrones.
Enlace covalente no polar
Este tipo de enlace ocurre en el intercambio entre pares de electrones que poseen una carga negativa similar o igual entre sí. Esto permite una distribución ecuánime de los electrones.
Enlace covalente coordinado
Este enlace covalente recibe el nombre de coordinado –o dativo– debido a que uno solo de los átomos que integran el enlace aporta sus electrones.
Enlace covalente doble
Sucede cuando se comparten dos pares de electrones entre dos átomos diferentes, que brinda un resultado total de cuatro electrones compartidos.
Enlace covalente simple
Para que este enlace suceda, cada átomo comparte un electrón para poder así completar el par de electrones necesario.
Enlace covalente triple
En este tipo de enlace se comparten tres pares de electrones, es decir seis electrones para poder generar un enlace triple.
Características de los enlaces covalentes
Es importante saber que:
- Los enlaces covalentes solo se pueden formar entre elementos no-metálicos.
- Los enlaces covalentes son mucho más estables cuando no son polares, es decir, cuando la presencia de electronegatividad en los átomos es similar entre sí.
- Para poder compartir electrones, siempre se debe realizar en enlaces pares, ya sean simples, dobles o triples.

