En 1925, Ernst Pauli, un eminente físico oriundo de Austria e investigador de la física cuántica, desarrolló el principio que lleva su nombre y que describe que no pueden existir dos partículas con el mismo número cuántico. De esto se desprende que tampoco pueden existir dos electrones con el mismo número cuántico dentro de un átomo, por lo cual estos se distribuyen en niveles alrededor del núcleo. Cuantos más electrones tiene un átomo, más niveles se forman (puesto que sólo caben 2n^2 electrones en cada nivel) y esto los hace crecer de tamaño.
Para explicar mejor este principio, veremos los casos del átomo de hidrógeno y de los orbitales.
Átomo de hidrógeno
Para dar una correcta descripción de la forma que tienen los electrones dentro de los átomos de hidrógeno, es obligatorio que se añada un cuarto número cuántico, el cual será simbolizando con las letras ms. A este nuevo número cuántico se lo denomina “número cuántico de spin” y está relacionado al magnetismo de los electrones.
Por otro lado, el ms o número cuántico del spin admite solo los valores +1/2 o -1/2. Cuando dos electrones poseen el mismo número de spin, se considera que poseen spines paralelos; si, en cambio, dos electrones tienen diferentes ms, entonces se dirá que tienen spines opuestos o spines antiparalelos.
Principio de exclusión de Pauli en los Orbitales
En los orbitales se necesitan los números cuánticos llamados n, l y ml, y, además, a un electrón que provenga de un átomo que sume los tres números cuánticos clásicos y el ms.
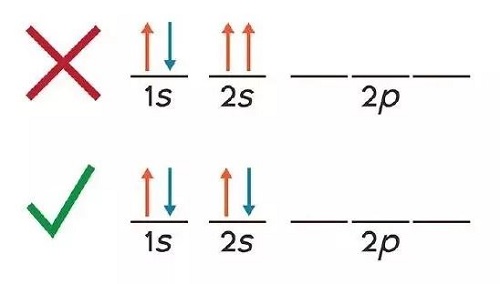
Según hemos visto, el principio de exclusión de Pauli reza que no pueden existir dos electrones con los mismos cuatro números cuánticos en un mismo átomo. Por ello, se determina que en los orbitales atómicos que posean los número cuánticos antes vistos (es decir, el n, l y ml) puede haber sólo 2 electrones: uno con spin positivo (+1/2) y otro con spin negativo (-1/2).
En resumen, podemos decir que cada tipo de orbital contiene un máximo de 2 electrones cuyos spines deben ser obligatoriamente contrarios y cuyos números cuánticos serán idénticos, salvo por el número cuántico ms o número de spin.
Configuración electrónica
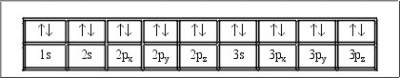
Si recordamos que los electrones se distribuyen en niveles o capas, a la hora de representar un orbital se lo indicará con dos flechas: una hacia arriba y otra hacia abajo, lo cual viene a significar que en ese orbital hay dos electrones con spines opuestos. A esta representación se la conoce como “configuración electrónica” o también “representación de llenado de orbitales electrónicos”.
Para graficar esta configuración electrónica, se comienza llenando el orbital 1S y luego los demás, mientras que en medio se insertan los electrones de a uno hasta completar los espacios de cada orbital como se indica en el gráfico de aquí abajo.
Otras aplicaciones del principio de exclusión de Pauli
Además de lo mencionado, este principio también sirve para dar explicación de la estabilidad que tienen los orbitales atómicos y también la presión que ejerce la materia degenerada.

