Se llama oxidación de Swern a un proceso por el cual se conforma un grupo carbonilo, el cual se une a 2 cadenas laterales las cuales, a su vez, pueden llegar a crear una cetona o un aldehído.
Historia de la Oxidación de Swern
La oxidación de Swern es un descubrimiento contemporáneo y bastante reciente, ya que fue recién en 1976 cuando Daniel Swern y sus colaboradores declararon que si el DMSO (Dimetilsulfóxido) es tratado con Anhídrido trifluoroacético (TFAA) a -50 °C en diclorometano, lo que ocurre es que se produce el trifluoroacetato de trifluoroacetoxidimetilsulfonio, el cual es proclive a reaccionar con alcoholes 1º o 2º.
Si, además, a este trifluoroacetato de alcoxidimetilsulfonio se le añade trietilamina (Et3N), entonces se produce la oxidación que generará los aldehídos y/o cetonas, según corresponda.
Dos años más tarde, en 1978, se sustituye el TFAA por cloruro de oxalilo, el cual se comprueba que tiene mayor eficacia como agente activador del DMSO 2 mientras ocurre la oxidación de alcoholes.
Características generales de la reacción
El solvente más usual en la oxidación de Swern es el Diclorometano o DCM. Se trata de un proceso típico que empieza con la reacción entre el DMSO y el cloruro de oxalilo (o TFAA, según se considere uno u otro) a baja temperatura, generalmente se trabaja a unas temperaturas por debajo de los -78 ºC. Luego se añade lentamente el alcohol y, seguidamente, una amina terciaria (la cual puede ser DIPA= diisopropilamina o TEA= trietanolamina), que facilita la descomposición del alkoxisulfonio, una sal que se forma durante el proceso. El impedimento estérico del sustrato no influye sobre la eficiencia de la oxidación.
Precauciones a tener en cuenta
Es fundamental utilizar solventes ya que, de lo contrario, el DMSO reacciona de manera explosiva en contacto tanto con el cloruro de oxalilo como con el TFAA. En caso de usarse este último, es decir, el TFAA hay que tener en cuenta que, por encima de los -30 ºC, el primer intermediario es inestable y forma un producto secundario mediante el llamado reordenamiento de Pummerer.
Al usarse cloruro de oxalilo, el primer intermediario es inestable por encima los -60 °C y si bien no aparecen productos secundarios, los subproductos son bastante raros. Es por esto que se prefiere trabajar la oxidación a los -78 ºC.
Mecanismo de la Oxidación de Swern
La oxidación de Swern consiste de tres pasos:
- Una primera etapa, que ocurre a menos de -30 ºC y en la cual el dimetilsulfóxido (DMSO) ataca al anhídrido trifluoroacético, de manera nucleofílica, lo que provoca que se expulse una unidad de trifluoroacetato, la cual se une al intermediario trifluoroacetoxidimetilsulfonio. Como hemos dicho antes, en este caso se forman productos secundarios mediante un reordenamiento de Pummerer (siempre que las temperaturas sean superiores a -30 °C).
- La segunda etapa tiene lugar cuando el alcohol 1º o 2º ataca al átomo de azufre encima del producto secundario, lo que origina un nuevo reordenamiento y se expulsa una molécula de ácido trifluoroacético con la cual se forma una sal de alcoxisulfonio. Esta sal perderá un hidrógeno cuando sea atacada por la amina terciara y así quedará únicamente un iluro de alcoxisulfonio.
- Por último, ocurre un reordenamiento intramolecular en el iluro, lo que hace que expulse al tioeter y se liberen el aldehído o cetona correspondiente.
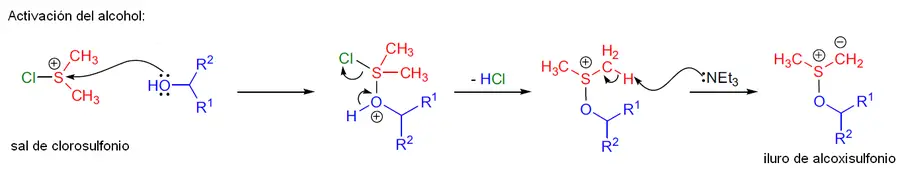
Mecanismo alternativo
Este procedimiento es el más usado y sustituye al anhídrido trifluoroacético por cloruro de oxalilo. También tiene 3 pasos o etapas:
- El dimetilsulfóxido agrede a uno de los grupos carbonilo del cloruro de oxalilo. Esto hace que se expulse un ion cloruro, el cual captura una unidad de dimetilsulfóxido y forman juntos una sal de clorosulfonilo, cuyos subproductos son el dióxido y monóxido de carbono.
- Esta sal de clorosulfonio es atacada por el alcohol y pierde ácido clorhídrico (HCI). Cuando la amina terciaria interviene, roba un protón al átomo de hidrogeno correspondiente al intermediario y se libera así el iluro de alcoxisulfonio.
- Finalmente, igual que en el primer mecanismo, se produce un reordenamiento intramolecular dentro del iluro, por lo que se expulsa el tioeter y se liberan el aldehído o la cetona según corresponda.

