
Esta regla o teoría química explica la manera en la cual se combinan los átomos de los elementos químicos.
Historia y enunciación de la Regla del Octeto
En 1917, el físico y químico estadounidense Gilbert N. Lewis enunció esta teoría, según la cual los átomos de los distintos elementos químicos mantienen una configuración electrónica estable gracias a la ubicación de 8 electrones en sus últimos niveles energéticos. De aquí es que se toma el nombre de regla del octeto, que se simplifica diciendo que los iones de los elementos periódicos completan sus últimos niveles de energía con 8 electrones.
Utilidad de la regla del octeto
Gracias a esto, las moléculas adquieren una estabilidad cercana a la de los gases nobles que poseen una estructura electrónica tan estable que los hace poco reactivos. De este modo, los elementos con alta electronegatividad, como halógenos y anfígenos, tienen tendencia a ganar electrones para completar el octeto. Por su parte, los alcalinos o alcalinotérreos, que poseen baja electronegatividad, pierden sus electrones hasta quedar en un octeto.
Esta regla suele favorecer el predecir cómo se comportarán las moléculas resultantes de los enlaces entre átomos que sigan esta regla. Aunque hay que aclarar que existen excepciones.
En el caso del agua, el oxígeno completa su último nivel de energía con 8 electrones mientras que el hidrógeno lo hace con 2.
Excepciones a la regla del octeto
Existen varios compuestos que escapan a esta regla, puesto que no necesitan del octeto de electrones para alcanzar su estabilidad máxima. Alguno de estos son: el fósforo (P), azufre (S), selenio (Se), silicio (Si) o helio (He).
El hidrógeno (H), por su parte, solo tiene un electrón en su único orbital atómico y acepta tan solo 2 para un enlace químico.
El berilio (Be), que adquiere estabilidad con 4 electrones, y el boro (B), que lo hace con 6 son otras excepciones.
Regla del octeto y estructura de Lewis
La estructura de Lewis es una forma gráfica, la cual permite visualizar los electrones libres y compartidos. También se la llama “fórmula de Lewis” Esta estructura es un conjunto de puntos o guiones, los cuales representan a los electrones que comparte una molécula así como los que quedan libres alrededor del átomo.
La principal ventaja de este gráfico es que permite anticipar la valencia de un átomo en interacción con otros y la manera en que formará enlaces con ellos: simples, dobles o triples. Esto influye en la geometría molecular.
La forma de realizar este gráfico para una molécula es bastante sencilla: primero se elige al átomo central, al cual van a rodear los demás (a los que llamaremos “terminales”), para establecer los enlaces necesarios hasta alcanzar todas las valencias involucradas. Para determinar esto se suele poner en el centro a los menos electronegativos y luego los de mayor electronegatividad.
Usemos como ejemplo a la molécula de agua o H2O. Si la representamos como indica Lewis, podemos ver los electrones libres del átomo de oxígeno, así como los enlaces simples entre el átomo de oxígeno y los dos de hidrógeno. Para ver esto claramente, dispusimos los electrones del oxígeno en color rojo, mientras que los del hidrógeno son de color negro.
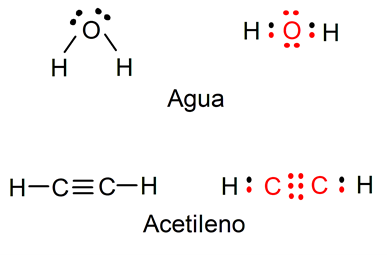
Otro ejemplo es la molécula de acetileno (C2H2), en la cual podemos ver que existe un enlace triple entre los 2 átomos de carbono, así como los enlaces simples que unen cada átomo de carbono con uno de hidrógeno. Para verlo mejor, los electrones del carbono son rojos y los de hidrógeno, negros.

