Un modelo atómico es la representación gráfica de la dimensión atómica de una determinada materia, con el objetivo de analizar más fácilmente los átomos desde un esquema que muestre sus propiedades y comportamiento.
Estos modelos han sido desarrollados desde los más antiguos orígenes de la ciencia en la Grecia Clásica y se han adaptado a las concepciones que cada época tuvo de la forma en que se compone la materia.
Tipos de modelo atómico
Desde el modelo de Demócrito en el año 450 antes de Cristo hasta los estudios cuánticos de Schrödinger, pasó más de un milenio en el cual se formaron diferentes tipos de modelos atómicos. Pasando por Bohr, quien diseñó el modelo que explicaba cómo los electrones orbitaban en torno al núcleo atómico, pero basándose en las ecuaciones que permiten explicar este fenómeno y no en la representación física del átomo.
Modelo atómico de Demócrito
El siglo V antes de Cristo se denominó “siglo de oro”, debido a la proliferación de las ciencias y las artes en la Grecia clásica. Entre los principales filósofos que se preocuparon por estudiar al universo y sus componentes, encontramos a Demócrito, quien propuso la idea de un mundo formado por diminutas partículas indivisibles: los átomos, que según este modelo eran eternos, con diferentes formas y tamaños, pero con un funcionamiento idéntico e incomprensible para los humanos. Epicuro diría después que los átomos podían moverse de manera aleatoria. Según Demócrito, además, la agrupación de los átomos era lo que determinaba las propiedades de la materia.
Teoría atómica de Dalton
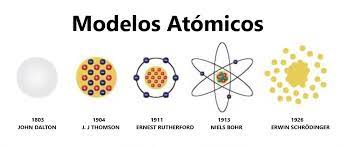
A principios del siglo XIX, John Dalton planteó un nuevo modelo que, si bien ha sido superado, constituye otro hito histórico: la materia se compone de átomos, los cuales siguen siendo indivisibles, pero ahora sólo son idénticos aquellos que pertenecen a un mismo elemento.
Además, los átomos de Dalton eran indestructibles, incluso durante las reacciones químicas, aunque en estos casos podía ocurrir una unión de átomos que creaba compuestos químicos.
Por otro lado, postuló la existencia del peso atómico relativo, el cual se calculaba comparando la masa de cada elemento con la del hidrógeno.
Modelo atómico de Thomson
Antes de conocerse la existencia de protones y neutrones, J.J. Thompson propuso un modelo atómico que contemplaba la existencia de los electrones. Según este modelo, los átomos se formaban por una esfera de carga positiva en la que se encajaban los electrones de carga negativa. La forma de estos átomos le valió a esta teoría el nombre de “Modelo del Pudín de Pasas”.
Modelo atómico de Rutherford
Esta teoría vino a refutar la anterior al demostrar que los electrones y protones en realidad giran alrededor del núcleo atómico en el cual, según Ernest Rutherford, se concentra casi la totalidad de la masa y su caga positiva.
Modelo atómico de Bohr
Este modelo de 1913 se considera una transición entre la física clásica y la cuántica y puede resumirse en tres tópicos: que los electrones orbitan al núcleo de manera circular y sin irradiar energía. Que las órbitas permitidas son las que tienen un momento angular que sea múltiplo entero del valor, siendo h=6.6260664×10-34 y n=1, 2, 3…. Y, por último, que, al pasar de una órbita a otra, los electrones irradian o atraen energía, lo que genera un fotón, el cual representa la diferencia de energía entre ambas órbitas.
Modelo atómico de Sommerfeld
Este modelo, ideado por Arnold Sommerfeld, se basa en la teoría de la Relatividad de Albert Einstein y surgió para cubrir las falencias del modelo de Bohr. A saber: las órbitas de los electrones pasaron a ser elípticas como las de los planetas; que los electrones ahora se consideraban con dosis mínimas de corriente eléctrica; y que recién a partir del segundo nivel de energía existen dos o más subniveles.
Modelo atómico de Schrödinger
También llamado “modelo cuántico-ondulatorio”, es el modelo que sigue teniendo vigencia en nuestros días, aunque ha recibido pequeñas adiciones. Fue propuesto por el conocido Erwin Schrödinger (el mismo de la paradoja del gato y la caja) a partir de los dos modelos anteriores, pero entendiendo a los electrones como ondulaciones de la materia, de ahí su nombre.
Esta concepción permitió a Max Born formular la interpretación probabilística de la función de onda, la cual es una magnitud que describe la probabilidad de encontrar a una partícula en el espacio. Esto se relaciona con el Principio de Incertidumbre de Heinsenberg, que indica que, probabilísticamente, es posible averiguar la posición de un electrón o su cantidad de movimiento, pero no ambas al mismo tiempo.

