Se llama proceso isotérmico o isotermo a aquella mutación reversible que ocurre en un sistema termodinámico, en el cual la temperatura se mantiene constante.
Compresión y expansión de gases
Cuando queremos comprimir o expandir un gas ideal, podemos hacerlo poniendo al gas en contacto térmico con otro sistema que tenga la misma temperatura que el gas y, a su vez, su capacidad calorífica sea grande. A este segundo sistema se lo llama foco calórico.
Este proceso permite que el calor se trasmita muy despacio, por lo que el gas se expande por sí mismo. Por otro lado, la energía interna de un gas ideal depende solamente de la temperatura y como ésta permanecerá inalterable durante la expansión, podemos decir que el calor que se toma del foco es igual al trabajo que hace el gas: Q = W.
¿Qué es la curva isotérmica?
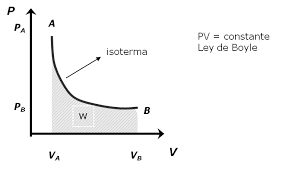
La curva isoterma es aquella línea que trazamos sobre un diagrama para representar los valores consecutivos de las variables que posee el sistema durante el proceso isotérmico.
Por ejemplo: las isotermas de un gas ideal representadas en un diagrama P-V, también llamado diagrama de Clapeyron, resultan ser hipérbolas equiláteras con la ecuación P•V = constante.
Procesos isotérmicos en los gases ideales
La Segunda Ley de Joule reza que la energía interna de un total fijo de gas depende solamente de la temperatura. Por lo cual, durante un proceso isotérmico, la energía interna del gas ideal es constante. Esto se debe a que dentro de un gas ideal no hay fuerzas intermoleculares, por lo tanto, la energía interna está sujeta a la presión, la temperatura y el volumen.
Gracias a lo anterior es que pueden realizarse la comprensión o la expansión del gas ideal colocándolo en contacto térmico con otro sistema que tenga la misma temperatura del gas ideal y una capacidad calorífica grandísima. Durante el proceso, el trabajo realizado termina por alterar el volumen y la presión, por lo que este trabajo hace que la energía interna varíe y hay una tendencia al aumento de la temperatura.
Para que esta última se mantenga constante, es necesaria una compensación de calor con el exterior. Durante la expansión isotérmica, el calor es absorbido, mientras que en la compresión, se lo cede. Pero en ambos casos, la cantidad de calor trasferido es igual al trabajo realizado.
Ejemplos de proceso isotérmico
Los procesos isotérmicos pueden darse en cualquier sistema donde se pueda regular la temperatura. Veamos algunos ejemplos:
- Los cambios de estado de los líquidos, ya sea por fusión (de líquido a sólido a 0º C) o por evaporación (de líquido a gaseoso a 100º C).
- En la máquina de Carnot, parte del ciclo que lleva el mismo nombre se realiza con una temperatura constante.
- También son isotérmicas varias reacciones que ocurren dentro del refrigerador o de bombas de calor, donde las temperaturas son estables.
- Las interacciones entre células dentro de un organismo también se valen de procesos isotermos.

