
En el artículo hablaremos sobre este tipo de energía, los fenómenos relacionados al calor y su diferencia con la temperatura.
Qué es el calor
Se conoce como calor a un tipo de energía en tránsito, detectable al ingresar a un sistema termodinámico; es decir, un sistema que convierta este tipo de energía en otra, o que la transporte. Es por eso que se considera como calor al proceso de transferencia de calor en sí mismo.
La transferencia podrá ser interna, cuando el calor se convierte en parte de la energía de los sistemas o su alrededores; o externa, cuando el calor es emitido y transferido desde el interior de un sistema hacia sus exteriores.
Mediante estas definiciones, se toma como principio físico que la transferencia de calor se lleva a cabo en caso de entrar en contacto dos sistemas a diferentes temperaturas. Por lo tanto, no hay transferencia de calor en dos sistemas a igual temperatura.
Concepto y características del calor
Los cuerpos no poseen calor en sí, ya que el calor, como vimos anteriormente, se define por su capacidad de transferencia. De ello deducimos que cada cuerpo posee una energía determinada en un determinado momento, la cual puede variar alterando alguna condición externa, como puede serlo la presión o la temperatura.
Esta energía se denomina energía térmica de un cuerpo y considera a éste como un sistema termodinámico. La energía térmica está determinada por la energía molecular, es decir, el movimiento de moléculas del material en diferentes estados. A mayor energía molecular, mayor energía cinética, mayor movimiento de partículas y mayor temperatura.
Asociados a la transferencia de calor, se encuentran los diversos tipos de calores:
- Calor específico: Depende del material, es la relación entre el calor proporcionado a una masa de sustancia y el incremento de temperatura.
- Calor específico molar: Se define como la cantidad de energía que se requiere para elevar en un grado la temperatura de un mol de sustancia.
- Capacidad calorífica: Es una constante que indica si el material tiene mayor o menor dificultad para modificar su temperatura ante el calor.
Unidades de medición del calor
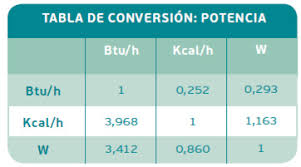
- Joule (K): Se usa para medir calor específico.
- Caloría (cal): Representa la cantidad de energía que hay que entregar a un gramo de agua para que incremente su temperatura en 1 °C.
- Kilocaloría: Se usa como una magnitud proporcional de la caloría para simplificaciones. En equivalencia, una kilocaloría equivale a mil calorías.
- Unidad térmica británica (BTU): Se asocia esta unidad a la medición en ambientes y maquinarias industriales.
Instrumento de medición
Para medir el suministro o incremento de calor se utiliza un instrumento denominado calorímetro, el cual mide el calor específico así como las cantidades transmitidas de calor.
El calorímetro se compone de un envase aislado y cerrado, el cual contiene agua y un termómetro, aparte de un dispositivo para agitar. Al colocar una fuente de calor sobre él y agitarlo, el calorímetro experimentará un aumento de temperatura que se podrá registrar con el termómetro. Si contamos con la capacidad calorífica del calorímetro, se puede calcular la cantidad de energía liberada.
Diferencia entre calor y temperatura
Pese a estar relacionados, estos dos conceptos no son iguales. La temperatura es una medida de la energía cinética de los átomos en un sistema y no depende de la cantidad de la sustancia, ya que si está toda a la misma temperatura, este valor será el mismo.
Mientras tanto, el calor es la energía medida por la temperatura, es el proceso de transferencia de calor entre cuerpos y podrá variar en función de la cantidad de sustancia empleada.
Por ejemplo, la temperatura de un café será la misma en una taza que en una jarra, pero al tener la jarra más líquido, tendrá mayor energía térmica para transferir calor.

