
La termoquímica es la rama de la química que estudia la energía liberada o absorbida durante las transformaciones que sufre la materia durante las reacciones químicas.
Tipos de reacciones químicas
Según cómo actúe el calor, las reacciones químicas pueden ser:
- Endotérmicas: cuando absorben el calor externo. N2 + O2 + CALOR = 2 N O
- Exotérmicas: cuando liberan calor hacia el medio en el cual se producen. C + O2 = CO2 + CALOR
La cantidad de calor que liberan o absorben estas reacciones puede calcularse con la siguiente ecuación: Q = m . c . Δt
En este caso, Q simboliza la cantidad de calor liberada, la cual es medida en joules o calorías liberadas. La m simboliza a la masa de la substancia que absorbe o emite calor. La c es el calor específico de la substancia. Por último, Δt es la variación de temperatura.
La equivalencia entre joules y calorías es de: 1 cal = 4,18J
Sin embargo, cabe aclarar que, dado que la cantidad de calor que interviene en una reacción química suele ser grande, lo más usual es usar kilocalorías y kilojoules, cuya equivalencia es: 1kcal = 1000 cal / 1 KJ = 1000 J
Origen del calor
Ahora bien, seguro alguna vez te preguntaste de dónde proviene el calor que se desprende de las reacciones, por ejemplo de la combustión de la madera.
Pues bien, todas las especies químicas tienen una cuota de energía que se llama entalpía (H) cuando se la mide a presión constante. Sin embargo, no podemos calcular la entalpía de un sistema, por lo cual es necesario calcular su variación o ΔH de la siguiente manera:
ΔH = H final – H inicial
En los procesos endotérmicos, ΔH > 0 mientras que en los procesos endotérmicos ΔH < 0. Lo cual queda graficado así:
Procesos exotérmicos:
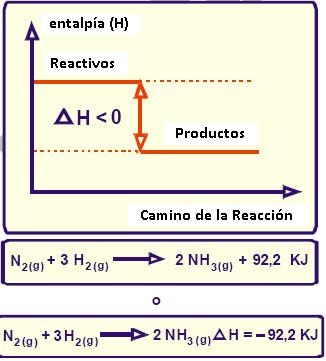
Procesos endotérmicos:
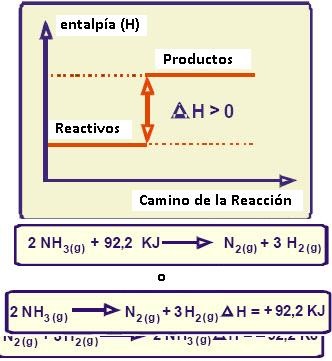
Factores que afectan la entalpía de las reacciones
Existen varios factores que afectan a la entalpía de las relaciones. Veamos cuáles son y cómo lo hacen.
Cantidades de las especies químicas:
La cantidad de valor que interviene en una reacción química depende de las cantidades de reactivos y productos.
El valor de variación de entalpía junto a la ecuación química son las cantidades expresadas en moles. Así, en este ejemplo se ve que 2 moles de H2(g) reaccionan con 1 mol de O2(g) , produciendo 2 moles de H2O(l) con liberación de 572 kJ.
![]()
Si dividimos todos los coeficientes por 2, la variación de entalpía también será dividida por 2.
![]()
Estado Físico de los Reactivos y Productos
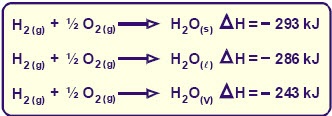
Lo cual se grafica del siguiente modo:
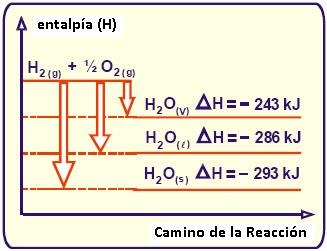
Estado Alotrópico
El estado alotrópico de la sustancia influye en la entalpía de la reacción de manera que la forma alotrópica que tiene más entalpía, resulta más relativa, mientras que las de menor entalpía son más estables.
Las formas alotrópicas de las sustancias más comunes son: el azufre romboidal (más estable) y el monoclínico; el fósforo rojo (más estable) y fósforo blanco; el oxígeno (más estable) y el ozono; y el grafito (más estable) y el diamante.
En este ejemplo vemos que el diamante tiene una mayor acumulación de entalpía que el grafito.

Ecuación Termoquímica
Es la ecuación química que incluye la variación de entalpía de la reacción, los estados físicos de las sustancias y las condiciones de temperatura y presión en las que ocurre.
También cabe aclarar que, si la ecuación termoquímica es endotérmica en un sentido, será exotérmica en el contrario. Y que si no se aclaran los valores de presión y temperatura, quiere decir que se corresponden con las condiciones ambiente.

