
Se considera a un elemento perteneciente al grupo de los metales a aquel que ocupa un lugar en la sección de elementos metálicos de la tabla periódica (alcalinos, alcalinotérreos, de transición, lantánidos, actínidos y transactínidos) debido a un comportamiento específico de este grupo: La conducción, en mayor o menor medida, de la electricidad y del calor.
Características de los Metales
Son elementos de densidad alta. Generalmente son sólidos a temperatura ambiente, a excepción del mercurio. Muchos metales pueden reflejar la luz, hecho que les otorga su brillo característico. Se pueden encontrar en la naturaleza, especialmente en la corteza terrestre en todos sus niveles y en mayor o menor pureza. La mayoría de los metales se encuentran por debajo del nivel de tierra, por lo que se debe acceder al subsuelo para su extracción.
Propiedades físicas de los metales
- Maleabilidad: Al ser comprimidos, los metales forman láminas delgadas y homogéneas.
- Tenacidad: Tienen resistencia a la fractura al ser expuestos a fuerzas como caídas o golpes.
- Conductividad: Al tener buena conductividad eléctrica y térmica, se utilizan dentro de la industria de la energía, así como la automotriz y la electrónica.
- Ductilidad: Siendo sometido a una fuerza de tracción, el metal se transforma en hilo de ese material de manera homogénea.
- Resistencia mecánica: Los metales poseen capacidad para soportar tracción, torsión, compresión y otro tipo de fuerzas sin deformaciones de ningún tipo.
- Brillo: Esta característica lo convierte en ideal para forjar items de valor como joyas u objetos decorativos.
Clasificación de metales y ejemplos
La tabla periódica clasifica los elementos metálicos en base a sus propiedades en los siguientes bloques:
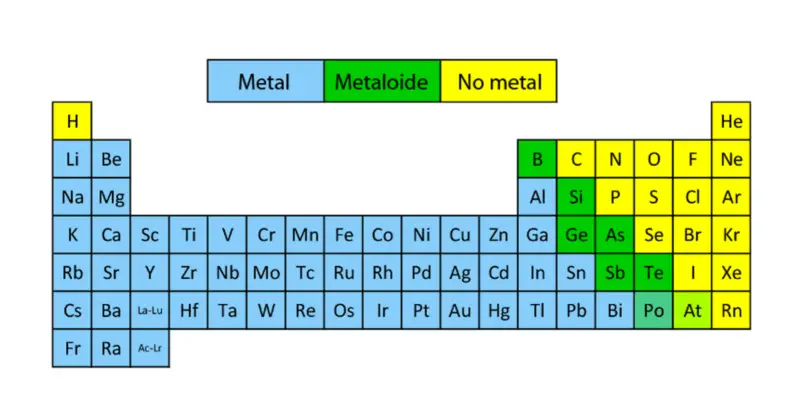
- Metales alcalinos: Son reactivos en CNPT (condiciones normales de presión y temperatura, 1 atmósfera y 25 °C), brillantes y blandos. No se encuentran en estado puro en la naturaleza, tienen una densidad baja y una alta conductividad electrotérmica. Sus puntos de fusión y ebullición son bajos. Ejemplos: Potasio, cesio, francio, litio.
- Metales alcalinotérreos: Deben su nombre a las propiedades alcalinas de los óxidos de estos metales, llamados “tierras” antiguamente. Son más duros y menos reactivos que los alcalinos, también de baja densidad y color, son brillantes y buenos conductores. Ejemplos: Calcio, bario, estroncio, magnesio, berilio.
- Metales de transición: La mayoría de estos metales son duros, con puntos de fusión y ebullición elevados, además de excelentes conductores. Ejemplos: Hierro, cobalto, níquel, vanadio, cromo, cobalto, paladio, platino, titanio, oro, mercurio.
- Lantánidos: Son elementos de alta abundancia en la superficie terrestre, muy similares entre sí. Poseen comportamiento magnético al interactuar con campos de este tipo, además de comportamiento espectral al incidir sobre ellos algún tipo de radiación. Ejemplos: Cerio, lantano, erbio, tulio, lutecio, europio.
- Actínidos: Son elementos de número atómico alto y la mayoría de sus isótopos son radiactivos, por lo que son escasos en la naturaleza. Ejemplos: Torio, uranio, plutonio, curio, berkelio, nobelio.
- Transactínidos: Su número atómico es mayor que el de los actínidos, sus isótopos son de vida corta y radioactivos. Se obtuvieron mediante síntesis en laboratorios, por lo que llevan nombres relacionados a quienes los crearon. Ejemplos: Teneso, Rutherfordio, Bohrio, Copérnico.
